【瞩目】6款中药新药获批!中药复方、经典名方......研发难点与要点有哪些?
2024上半年,国内有6款中药新药获批上市,包括3款1.1类创新药及3款3.1类古代经典名方中药复方制剂。近年来,中医药层面利好政策不断,叠加中成药集采持续推进,中药研发一片火热,创新成果日渐丰硕。在2024米思会分会——盈科瑞独家协办的【米交汇】中医药创新生态合作论坛上,多位行业大咖齐聚一堂,探讨目前中药研发面临的难点与要点。
中药新药步入丰收期,专家呼吁以临床价值为核心
米内网数据显示,2020年以来,国内已有36款国产中药新药获批上市(不含非制剂产品),其中10款为呼吸系统疾病用药,6款为消化系统疾病用药,5款为神经系统疾病用药,骨骼肌肉系统疾病用药、五官科用药各有4款,妇科用药有3款等。
近年来中药新药获批情况(不含非制剂产品)
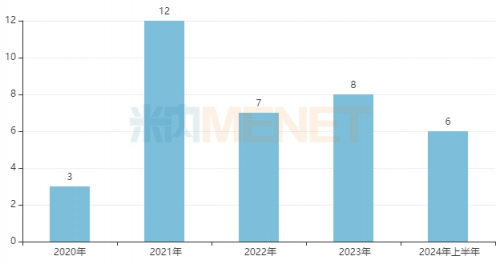
来源:米内网中国上市药品(MID)数据库
近年来,国家层面陆续出台多项与中医药相关的利好政策,其中,推进中医药高质量发展多次被提及。那么如何实现中医药行业高质量发展,中国医学科学院药用植物研究所原所长孙晓波认为,中药材的品质是基础,要建立从“地头”到“床头”全过程质控与可追溯;中药临床价值评价是核心,进一步评价中医药临床价值,需要建立符合中药特点和规律的方法技术体系;中成药上市后再评价与创新药物研发是动力,要以临床价值为导向培育优质高效的中药大品种。
目前市场上生产、销售的大多数中成药临床定位比较宽泛,其临床疗效和特色优势未能得到充分彰显,影响其合理应用,临床价值也被严重低估,不利于中医药行业的发展,因此进行临床价值评价很有必要。孙晓波提到几点:1、利用量-效关系证明有效性;2、通过与同类的中药或化药对比,证明药效强度;3、临床定位要准确,针对疾病(症)、疾病中的某一环节;4、通过西药叠加,达到单用西药不能实现的治疗效果。
临床价值也是评价一个中药项目是否有潜力的指标之一。“项目要想成果转化立项的顶层设计要从政产学研用五方面考虑,具体产品立项时,会考虑几个关键要素,包括临床价值、差异化优势、技术壁垒、政策法规等,要满足临床未被满足的需求,还要有企业自身独特的核心技术。”北京盈科瑞创新医药股份有限公司总裁张宏武说道。
上海医药集团中药研究所所长刘雳也提到,选择品种或项目,长期要看人口和疾病谱变化,中期要看政策法规方向,短期要看诊疗技术现状和发展趋势,找准未来的需求是大前提;而明确企业战略和聚焦领域是小前提,想清楚做什么和不做什么,理解自身的能力边界才能理性决策。
扬子江药业集团江苏龙凤堂中药研究院院长侯金才发表了类似的看法,他认为,中药研发基于临床需求、寻求差异化。选择项目后,临床方案的设定、工艺的设定等要回归到临床价值,并把每一步做到极致,把真正的好药带给消费者。
中药复方、经典名方......研发难题与要点有哪些?
中药复方是中医药学传统理念和智慧的典型代表,是中药新药的重要组成部分,是中药研发创新成果的重要体现。目前大多数的中药大产品均为复方制剂,且来自经典名方化裁或院内制剂总结优化再进行转化,那么对中药复方、经典名方等中药新药研发都有哪些难题与要点?
中药复方成分与作用机制都比较复杂,孙晓波认为,目前中药复方研究开发面临的3个关键技术难题,包括有效成分群辨识技术、有效成分群功-效关联性评价技术、有效成分群组方定量设计技术。
香港浸会大学药学博士、华药君康高级顾问黄韬分享了中药复方研究可供参考的路径,分别为:1、系统评价现有证据,是否有证据能表明现有产品治疗某种疾病的有效性与安全性;2、临床使用最佳剂量,通过多次剂量优化得出;3、临床试验-安慰剂对照,进行疗效评价研究;4、临床试验-一线药物对照,进一步评价安全性与有效性;5、复方物质基础研究,可应用机器学习和化学生物学方法确定其生物活性成分及靶标;6、复方作用机制研究,可通过成分组分析、代谢组学分析等。
谈及古代经典名方研究过程中需要注意的关键问题,北京盈科瑞创新医药股份有限公司科研总裁李艳英建议确认考证关键信息后再开展研究工作。在资源评估方面,文献调研和产地实际情况相结合,主要说明药材的质量可控,来源可溯,可持续稳定供应,不存在资源短缺濒危的风险。而药材研究、饮片炮制研究、基准样品研究、制剂研究、相关性和稳定性研究等五个方面,则需要遵循《按古代经典名方目录管理的中药复方制剂药学研究技术指导原则(试行)》。安全性研究,若毒理学试验中发现安全性隐患时,应考虑进行追加试验。
康臣药业集团副总裁李政海表示,在新品的立项开发中,中药1类新药的开发关注点主要落在院内制剂,其用于临床多年是比较靠谱的,但要突破数据收集困难、临床证据等级不一定高以及药学研究基础不一定符合申报要求等难点,是否一定要免除II期临床要慎重考虑,稳妥的策略是先做IIT研究,有一定的安全有效数据后,才好进一步投入后续的开发。2类新药的改良创新尤其是增加新的功能主治,对企业的商业化价值比较突出,也能得到中药保护,是可以重点策划的方向。经典名方要结合企业自身的品种规划及销售渠道优势,注重与现有品种的临床价值互补。开发过程中,要紧紧围绕开发的最终目标,以终为始,根据政策法规及市场的变化,尤其是临床的新需求和竞品的新进展进行阶段性评估,及时淘汰不符合企业开发目标的品种。
国际化大势所趋,如何借助“出海”抢市场?
中医药的国际化步伐,承载着传播中国传统医学智慧的使命,也是全球医疗健康领域多元化发展的重要推手,同时对于增强中医药在全球的影响力、推动中医药的现代化和产业化进程具有深远的意义。
基于已经完成上市的四个NDA/BLA植物药和数百个IND的审评实践经验, 以及FDA 2016年完成修订的新版《植物药研发指南》,植物药进入后期(如III期)临床及NDA提交的相关要求已日趋明朗。香港浸会大学中医药研发中心科学顾问窦金辉指出,质量可控和安全有效是中药走向国际的综合考量,而植物药比天然小分子的纯化药物有更能成为中药代表的新药走出去的途径之一。中药民族药成为世界级新药的挑战仍在于需要通过有对照的和设计良好的临床试验来证明其有效性与安全性,不像草药、保健品等非药物比较宽松的上市要求。此外,一些成熟中药产品,像风油精等蚊虫叮咬类产品可作为OTC药物去美国申请注册,批准后合规修改标签而拓宽国际市场。
借力港澳市场辐射海外市场,也是加速迈向国际化的途径之一。“目前港澳都有药械简化进口政策,其中香港、澳门本地登记的企业持有,并在港澳地区经批准上市且使用五年以上的传统外用中成药,可简化注册流程及注册数据,缩短审批时间,加快审批进程。目前已有13个港澳外用中成药获得进口注册许可,同时有10余品种在申报或准备申报;创新化药及医疗器械方面,境外化药经港澳简化注册进入大湾区医院使用,境外医疗器械经港澳公立医院使用可简化备案进入大湾区医院使用,目前广东省药品监督管理局已经公布了19家符合条件的医疗机构名单。”粤港澳大湾区药品与医疗器械真实世界研究院院长蒋杰如是说。
说到大湾区政策下医药国际化新机遇,蒋杰提到两点:一是走进来。引进一批港澳地区知名的外用药品牌,丰富产品线,并实现全国销售;提前“购买”一批香港口服中成药,静候大湾区放开港澳口服中成药简化进口注册政策;创新药械进口注册和大湾区医院引进“两条腿”一起走路,提前进入国内市场,积累真实数据和使用案例。二是走出去。巧用港澳中药注册制度的差异点,快速实现成果转化;利用港澳窗口开拓产品一带一路及国际市场;加快产品成果转化,扩大高端健康食品产线。
天士力医药集团副总经理、研究院执行院长周水平认为,重磅中药在前期是很难被直接定义的,产品上市只是第一步,后面的上市后再研究同样十分关键。基于临床价值的精准定位、填补临床空白,朝着这个方向一直深耕,是可以逐步做大做强的。如果再有信心往更高的层次去奋斗,可以尝试出海,抢夺更多的市场机会。
推荐资讯

全球顶尖海洋科学家齐聚国际深海科学与技术大会,纵论深海未来,发出《深圳倡议》拓展“深蓝”伙伴 共绘“深海”蓝图

《医美领袖之道》流量制胜,“轻医美+直播获客”成破圈利器

远航Y7和H9双星璀璨,重新定位中国式豪奢新能源车标杆!

劲风驰轮胎携欧洲漂移巨匠征战2024 DriftKings漂移之王系列赛匈牙利站,开启新赛季荣耀征程
聚力前行 多位专家学者齐聚清华研讨本色文化

全媒社携手澳大利亚城市明星网红,打造最新合作计划
国产蓝莓变身水果“顶流” 订单量暴增超1600%

27英寸VS 12.3英寸,锐界L和陆放的大屏你更买单哪个?

兴趣驱动:iEnglish九岁小学员1400天英文阅读之路



